Por: Catarina Coelho1, Cármen Nóbrega1, Madalena Vieira-Pinto2
1Médica Veterinária - Escola Superior Agrária de Viseu – Ins. Politécnico de Viseu
2Professora de Inspeção Sanitária. Mestrado Integrado em Medicina Veterinária da Universidade de
Trás-os-Montes e Alto Douro,
No seguimento do artigo anterior sobre o “Abate doméstico de suínos – Regras, riscos e responsabilidades” surge agora a oportunidade de desenvolver uma das doenças que foi abordada de forma sumária - a Triquinelose.
Atualmente na Europa, a triquinelose é considerada como uma doença reemergente de origem alimentar no Homem, tendo sido responsável, em 2009, por cerca de 1073 casos notificados na União Europeia.
Sabe-se que, na Europa Ocidental, a principal causa de triquinelose no Homem é a ingestão de carne de porco, de javali e de cavalo insuficientemente cozinhada (EFSA, 2011; Nockler et al., 2005). A importância relativa que a ingestão de cada tipo de carne assume como causa de triquinelose para o Homem é variável entre os diversos países, dependendo, sobretudo, dos hábitos alimentares locais (tipo de carnes mais consumidas e modo de confeção) e do tipo de exploração dos animais. Neste artigo apenas iremos abordar a problemática do suíno doméstico como portador desta doença e veículo de transmissão para o Homem. Contudo, apesar de limitarmos a nossa abordagem a esta espécie animal, gostaríamos de salientar que a presença desta parasitose nos suínos domésticos pode depender do tipo de exploração existente e do nível de parasitismo presente nos animais silváticos que convivem e partilham o mesmo habitat, dado que se revelam fundamentais na persistência e na dispersão desta doença zoonótica, uma vez que se tratam de animais nos quais o controlo é mais difícil.
O que é a Triquinelose?
A triquinelose é uma zoonose causada por um parasita nematode do género Trichinella (Figura 1). Neste momento, existem 9 espécies conhecidas: Trichinella spiralis (T. spiralis), T. nativa, T. britovi, T. murrelli, T. nelsoni, T. pseudospiralis, T. papuae, T. zimbabwensis e T. patagoniensis e 3 genótipos (T6, T8 e T9) (Pozio et al., 2009; Krivokapich et al., 2012).
Na Europa, encontram-se com maior frequência quatro espécies: T. spiralis, que afeta sobretudo animais domésticos, mas que também já foi associada ao ciclo silvático; T. britovi, que afeta animais silváticos na maior parte da União Europeia; T. nativa, encontrada em animais silváticos na Finlândia e na região norte e central da Suécia e T. pseudospiralis, encontrada em França, Finlândia e Itália, e que afeta mamíferos e aves (Pozio, 2001).
É uma doença que se encontra espalhada por todo o mundo, sendo endémica na maior parte dos países da União Europeia (Magalhães et al., 2004).
Esta doença está fortemente associada ao porco doméstico (Sus domésticos) e ao javali (Sus scrofa), mas a verdade é que pode afetar uma ampla variedade de animais (hospedeiros) domésticos e silváticos (Figura 2).

O Homem pode também ser afetado por esta doença e dado que esta lhe é transmitida a partir do consumo de carne de animais parasitados é designada de zoonose (doença transmitida ao Homem por animais) de origem alimentar.
Como se transmite ao homem? Ciclo de vida da triquinela
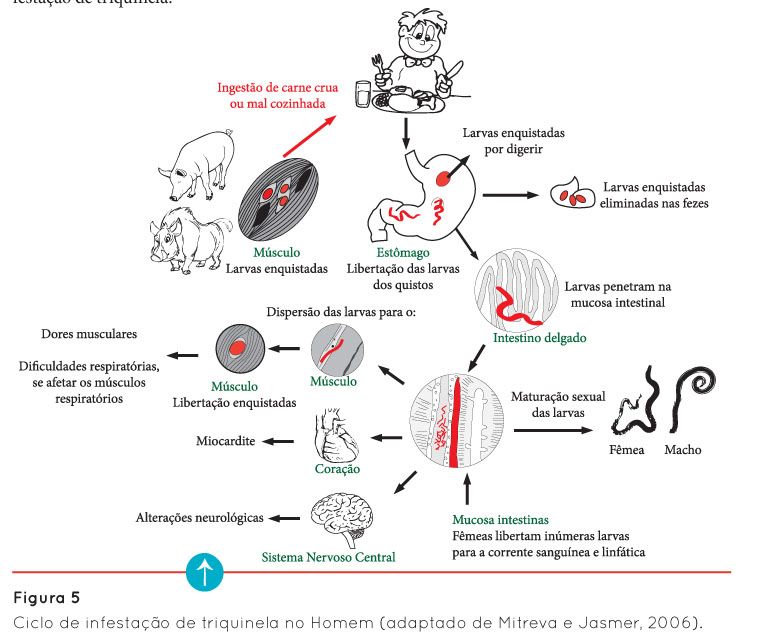
Os parasitas do género Trichinella desenvolvem todas as fases do seu ciclo de vida, a fase larvar e a fase adulta, num único hospedeiro (Homem ou animal).
A infestação do hospedeiro (Homem ou suíno, por exemplo) ocorre, sobretudo, através da ingestão de carne crua ou sujeita a inadequado processamento térmico, com a forma infetante enquistada da triquinela, nas suas células musculares. No estômago do hospedeiro, por ação do suco gástrico, ocorre a dissolução dos quistos de triquinela, permitindo a saída das larvas que, no intestino delgado, penetram na mucosa intestinal para sofrerem diversas transformações até atingirem a fase adulta - machos e fêmeas (Figura 3) (Fernández, 1999; Mitreva e Jasmer, 2006).
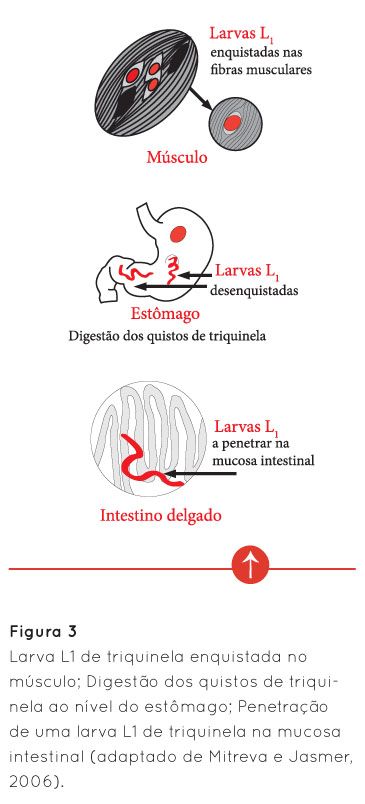
Após a cópula, o macho morre enquanto que a fêmea permanece na mucosa intestinal, produzindo entre 500 a 1000 larvas (Fernández, 1999; Mitreva e Jasmer, 2006). Estas entram na corrente sanguínea, dispersando-se pelo organismo do hospedeiro, tendo como alvos preferenciais os músculos esqueléticos de maior atividade, como por exemplo: o diafragma, os músculos intercostais e abdominais, a língua, os masseteres e os músculos oculares. Nestes músculos, a localização preferencial das larvas é na zona de transição entre o músculo e as suas porções tendinosas (Bartels, 1971; Fernández, 1999). Aqui, vai ocorrer o seu desenvolvimento, o qual termina, para a maioria das espécies de triquinela, com o seu enrolamento (Figura 4) e encapsulação, o que lhe confere uma imagem microscópica particular em forma de limão.
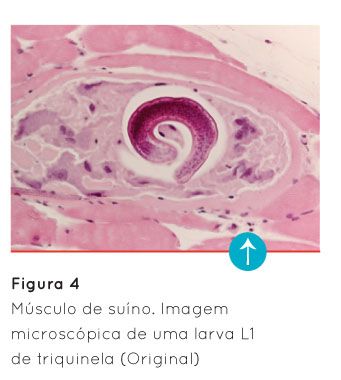
De uma forma geral, estes quistos musculares não são visíveis a olho nu, o que dificulta o seu diagnóstico no decurso do exame post mortem. No entanto, existem algumas situações que podem fazer com que estes quistos se tornem visíveis. Por exemplo, quando ocorre calcificação (a qual pode ocorrer com ou sem destruição da larva no seu interior) ou deposição de grande quantidade de gordura no interior da cápsula (Bartels, 1971). No caso de ocorrer calcificação, poder-se-á observar, a nível muscular, a presença de pequenas pontuações cinzento-esbranquiçadas, de consistência dura.
Durante a migração das larvas pelo organismo do hospedeiro, também pode ocorrer a sua “fixação” noutros tecidos menos usuais, como por exemplo o coração e o sistema nervoso central, provocando, nestes casos, insuficiência cardíaca e alterações neurológicas.
Não podemos deixar de terminar esta breve explicação do ciclo de triquinela sem antes referir que, por vezes, a dissolução dos quistos de triquinela a nível gástrico pode não ocorrer, fazendo com que estes passem intactos pelo trato digestivo e sejam eliminados nas fezes. Algumas larvas podem também não penetrar na mucosa intestinal sendo igualmente libertadas nas fezes do hospedeiro. Através destas fezes, a triquinela pode dispersar-se pelo meio ambiente, contaminando, por exemplo, o solo, a água e os vegetais e, desta forma, alcançar os hospedeiros (homem ou animais), parasitando-os. Considera-se que é através desta via que pode ocorrer a infestação de animais herbívoros.
A imagem seguinte (Figura 5) pretende apresentar, de uma forma simplificada, o ciclo de infestação de triquinela.
Como se manifesta no homem?
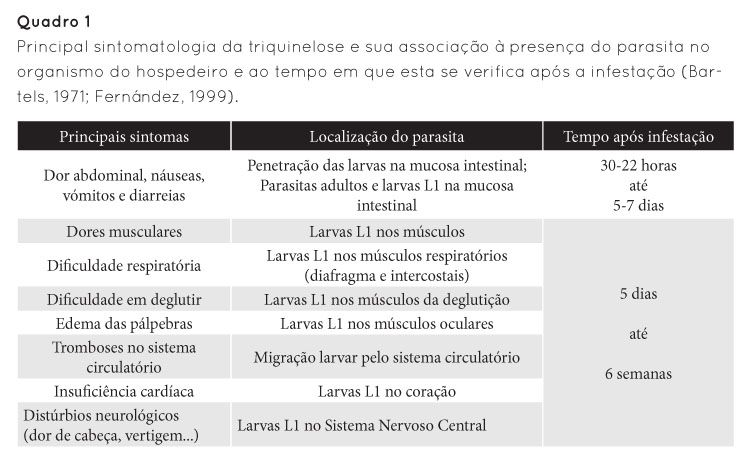
Os sintomas que podem estar associados à triquinelose estão dependentes do grau de parasitismo, da sensibilidade do hospedeiro e da localização do parasita, quer na sua forma larvar, quer adulta. Estes sintomas não são exclusivos desta doença e podem incluir, para além de um mau estado geral e de febre, sintomatologia de ordem intestinal, muscular, cardíaca e neurológica. Os principais sintomas encontram-se resumidos no Quadro 1.
Casos de Tiquinelose no homem e nos suínos
A triquinelose humana apresenta uma distribuição geográfica à escala mundial, assumindo um significado socioeconómico relevante em diversos países. A nível da União Europeia, considera-se que a triquinelose representa uma preocupação de destaque, tanto a nível médico como veterinário, em países como França, Alemanha, Itália e Espanha. No entanto, é sobretudo a nível dos países da Europa de Leste que esta parasitose tem assumido um papel de destaque como zoonose.
Da análise do último Relatório Europeu das Zoonoses e no que diz respeito à triquinelose humana, constatou-se que em Portugal, entre 2005 e 2009, não foram notificados quaisquer casos. Contrariamente, no nosso país vizinho, Espanha, no mesmo período, foram notificados 90 casos.
Acreditamos, no entanto, que todos estes valores possam estar subvalorizados, uma vez que no Homem, salvo em infestações massivas, é muito raro aparecerem sintomas ou quando estes ocorrem, como não são específicos, podem ser confundidos com um simples estado febril, não permitindo ao clínico diagnosticar a doença.
De acordo com vários autores, mais de metade dos casos de triquinelose humana referenciados em Espanha estão associados ao consumo de carne de javali não submetida a uma inspeção sanitária e deficientemente processados termicamente. Os restantes casos estão, sobretudo, associados ao consumo de carne de suíno de abate caseiro, também não sujeita a qualquer tipo de inspeção (Mora e Guevara, 2000; Sanz, 2000). Em Portugal, acreditamos que o cenário possa ser muito semelhante ao evidenciado por Espanha. No entanto, os únicos dados de Portugal relativos a triquinelose humana remontam aos anos 60 e são relativos ao consumo de carne de porco: o primeiro envolveu 5 pessoas (em 1962) e o segundo, que ocorreu em 1967, afetou apenas uma pessoa (EFSA, 2005).
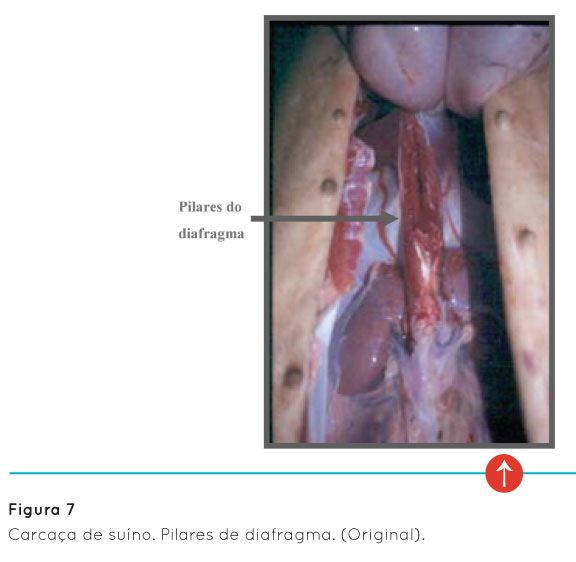
No que diz respeito à ocorrência desta doença em suínos domésticos em Portugal, nos anos de 2007 a 2009, não se notificou nenhum caso de triquinelose em suínos domésticos, contrariamente, mais uma vez, a Espanha, que notificou 189 casos.
No entanto, pela análise do mesmo quadro, verificamos que o número de animais amostrado foi muito diferente em ambos os países, 918.149 em Portugal e em Espanha, este número ascendeu a 120.161.308 animais, podendo este facto justificar, em parte, o número de casos encontrados, já que a metodologia analítica das amostras foi a mesma.
Relativamente aos registos nacionais de triquinela em porcos e javalis, sabe-se que, nos últimos 50 anos, apenas foi diagnosticado um único caso de triquinelose num porco de Montalegre em 1966 (EFSA, 2005). Contudo foram confirmados casos da existência de Trichinella spp. em animais silváticos (Magalhães et al., 2004; EFSA, 2011).
Como se previne?
As medidas de prevenção de triquinelose podem assentar em três pilares fundamentais: corretas práticas de maneio na produção/criação de suínos; pesquisa de triquinela muscular antes do consumo de carne; conservação e processamento da carne de suíno.
Corretas práticas de maneio na produção/criação de suínos
Como foi referido anteriormente, a infestação dos suínos ocorre através da ingestão de carne crua ou sujeita a inadequado processamento térmico, com a forma infetante enquistada de triquinela nas suas células musculares, ou seja, o suíno pode infestar-se através da ingestão de restos de comida ou de carne (fornecidos pelo Homem ou aos quais ele teve acesso) ou através da ingestão de cadáveres de animais (sobretudo ratos) infestados com triquinela. Por este motivo, a infestação dos suínos domésticos por triquinela ocorre, maioritariamente, em sistemas de produção ao ar livre onde não existem barreiras físicas que permitam a total separação do meio envolvente ou nos suínos criados em casa (Kapel, 2005).
Compreendendo a forma de infestação dos suínos, facilmente nos apercebemos que, de um modo geral, as principais medidas de prevenção a ter em conta no ciclo doméstico são:
- Não dar aos suínos carne crua ou sujeita a inadequado processamento térmico;
- Construção das instalações de modo a impedir o acesso de pássaros e roedores;
- Controlar a presença de roedores (armadilhas, evitar a acumulação de lixo que atrai os roedores);
- A obtenção do alimento concentrado em indústrias certificadas e armazenado em silos fechados para evitar a sua posterior contaminação;
- Eliminação correta dos cadáveres de animais;
- Tratamento térmico dos resíduos alimentares de origem animal administrados aos suínos domésticos para inativação de triquinela.
Pesquisa de triquinela muscular antes do consumo de carne
É importante salientar que a presença deste parasita no músculo não é, na maioria das vezes, visível a olho nu, sendo necessário recorrer a métodos laboratoriais para garantir que a carne consumida não apresenta risco relativamente à triquinela. Neste sentido, surge o Regulamento Europeu N.º 2075/2005 de 5 de dezembro (Figura 6) que veio estabelecer regras para o controlo oficial de triquinela nos matadouros, de forma a garantir a segurança do consumidor.

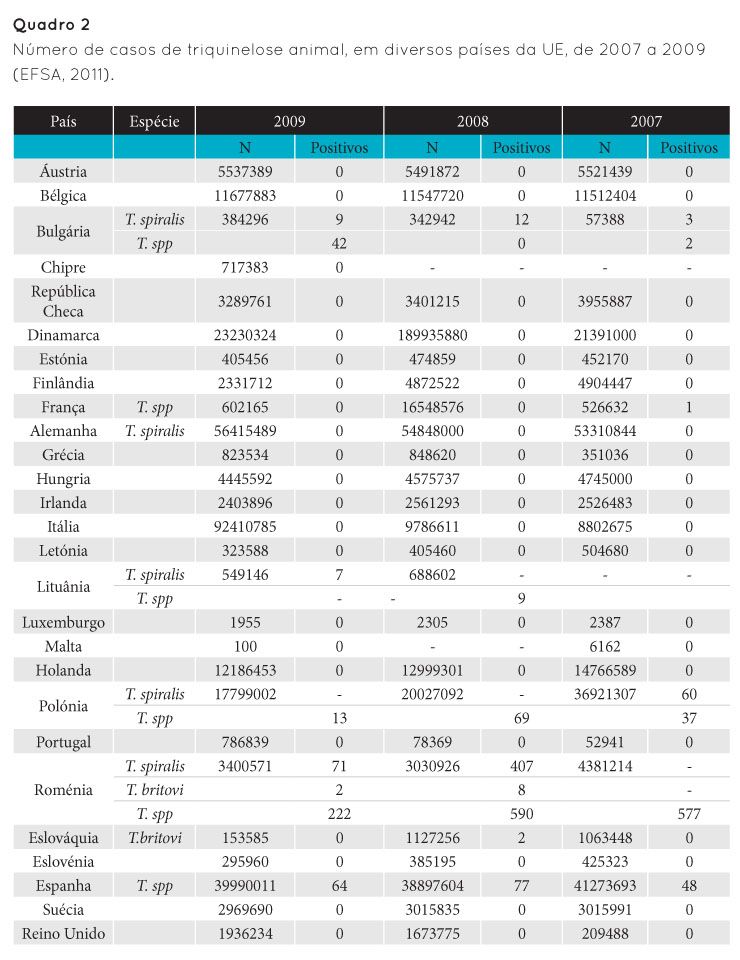
De acordo com o Regulamento Europeu (CE) N.º 2075/2005, todos os suínos abatidos para consumo cuja carne vai ser colocada no mercado têm de ser analisados para a pesquisa de triquinela. Este regulamento especifica ainda as normas relativas ao tipo e quantidade de amostras a analisar e o método de análise que deve ser utilizado para o efeito – método de digestão artificial. De acordo com este regulamento, recomenda-se, sempre que possível, que sejam recolhidos os pilares do diafragma (Figura 7), uma vez que estes são os músculos onde mais facilmente se encontram triquinelas em porcos. No entanto, se não houver pilares do diafragma, dever-se-á colher o dobro da quantidade de amostra, da parte do diafragma situada junto às costelas ou ao esterno, dos músculos mastigadores, da língua ou da musculatura abdominal.
Conservação e processamento da carne de suíno
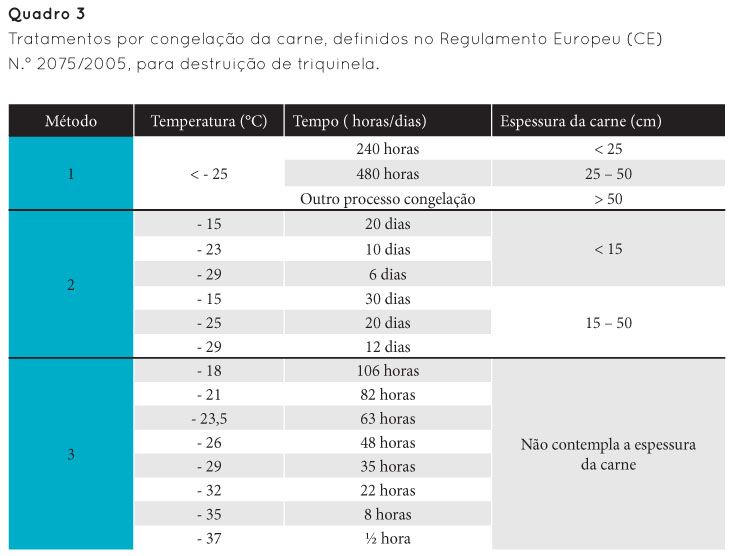
São dois os métodos de conservação e processamento da carne, referenciados na literatura, para destruir as larvas presentes nos músculos, de forma a eliminar a sua capacidade de infestação: a cozedura e a congelação. Relativamente à primeira, vários autores referem que, para que a destruição das larvas ocorra, é necessário que todas as porções da peça de carne atinjam uma temperatura de, pelo menos, 77°C. No que diz respeito à congelação, esta vai depender da espessura da carne a congelar, da temperatura e do tempo de congelação (Quadro 3).
Relembra-se, ainda, que as larvas de triquinela no tecido muscular podem ser resistentes à dessecação, à salga e à fumagem, pelo que a ingestão de enchidos crus, feitos com carne com este parasita, pode constituir um veículo de infestação para o Homem.
Em conclusão, gostaríamos de referir que, de facto, apesar de a triquinelose ser uma doença de origem alimentar potencialmente transmitida ao Homem através da ingestão de carne de suíno crua ou sujeita a um inadequado processamento térmico, esta doença pode ser facilmente controlada através de um conjunto integrado de intervenções, as quais devem incluir a implementação de boas práticas de produção e a utilização de tratamentos térmicos adequados da carne para matar o parasita (cozedura e congelamento eficazes). A consciencialização do leitor para a importância desta doença e para a sua intervenção, informada e ativa, na prevenção da triquinelose e, por inerência, na salvaguarda da saúde animal e humana, constituiu o principal objetivo da apresentação deste artigo, o qual esperamos ver alcançado.
Bibliografia
- Bartels H. Bergman G., Hadlok R., Waglmann H.(1971). Inspeccion veterinaria de la carne Pag. 290-296.Editorial Acribia. Zaragoza (España).
- DGV (Direcção Geral de Veterinária). Guia de Boas Práticas Sanitárias – Caça Maior.
- EFSA (2011). Trends and Sources of Zoonoses, Zoonotic Agents and Foodborne Outbreaks in 2009. EFSA Journal 2011; 9(3): 2090, Pp: 215-222.
- EFSA (2005). Risk assessment of a revised inspection of slaughter animals in areas with low prevalence of Trichinella. EFSA Journal. 200, Pp: 1-45.
- Fernández A.R.M. (1999). Parasitoses musculares - Triquinelosis Porcina. In ParasitologiaVeterinária. (Ed. Campillo, M.C.;F.A.R. Vazquez; A.R.M. Fernández; M.C.S. Acero; S.H. Rodríguez; I.N.L. Cozar; P.D. Bãnos; H.Q. Romero e M.C. Varela). McGraw-Hill, Madrid, España, Pp: 496-506.
- Fontes, M.C. (2001) Metodología de Inspecção Sanitária pot mortem em suínos. Protocolo de um trabalho prático. UTAD. 16Pp.
- Kapel, C.M.O. (2005). Changes in the EU legislation on Trichinella inspection – New challenges in the epidemiology. Veterinary Parasitology, 132: 189-194
- Krivokapich, S. J., Pozio E., Gatti G. M., Prous C. L. G., Ribicich M., Marucci G., La Rosa G., Confalonieri V. (2012). Trichinella patagoniensis n. sp. (Nematoda), a new encapsulated species infecting carnivorous mammals in South America. International Journal for Parasitology 42:903–910
- Magalhães A., Sousa C.B., Afonso-Roque M.M., Fonseca I., Meireles J., Fazendeiro M.I. e Madeira de Carvalho L.M. (2004). The role of wild boar and carnivores in the epidemiology of trichinellosis in Portugal. Galemys 16, 207-210.
- Mitreva M, Jasmer D.P. (2006). Biology and genome of Trichinella spiralis. WormBook 23:1-21
- Mora L. M. O., Guevara A. O. (2000). Ecopatologia en suidos silvestres. Principales enfermidades infecciosas y parasitarias del jabali. . Master Universitario en Gestión y conservación de la fauna salvaje euromediterrânea. Módulo II. Tema 53, Pp: 239-253.
- Murrel, K.D., Pozio, E. (2000). Trichinellosis: the zoonosis that won’t go quietly. International Journal for Parasitology, 30: 1339-1349
- Nockler, K.; Serrano, F. J.; Boireau, P.; Kapel, C. M. O.; Pozio, E. (2005) Experimental studies in pigs on Trichinella detection in different diagnostic matrices. Veterinary Parasitology, 132, Pp: 85-90.
- Pozio E. (2001). New patterns of Trichinella infection. Vet. Parasitol., 98, 133-148.
- Pozio, E. (2005). The broad spectrum of Trichinella hosts: From cold to warm-blooded animals. Veterinary Parasitology, 132: 3-11.