
Por: Henrique Trindade e Alfredo Aires*
*Departamento de Agronomia – Escola de Ciências Agrárias e Veterinárias / CITAB – Centro de Investigação e Tecnologias Agroambientais e Biológicas / Universidade de Trás-os-Montes e Alto Douro 5001-801 Vila Real, Portugal /

Efeito das siderações verdes e da adição de compostados vegetais ao solo no controlo de pragas e doenças na agricultura
A aplicação ao solo de resíduos orgânicos apresenta efeitos importantes na qualidade do solo, na produtividade vegetal e no ambiente. O seu uso como fertilizante é atractivo para os agricultores, especialmente em solos pobres em matéria orgânica como acontece na grande maioria das regiões portuguesas (Cabral et al., 1998), resultando em alterações benéficas sobre as propriedades físicas, químicas e biológicas do solo (Kuai et al., 2000).
A adição de elevadas quantidades de carbono (C) pelos resíduos vegetais, estimula acentuadamente a actividade microbiana do solo, com consequências para o ambiente. Os microrganismos do solo desempenham um papel-chave nas transformações ocorridas nos ciclos dos principais elementos, com destaque para os processos de transformação do C e do azoto (N) (Hattenschwiler et al, 2005; Geisselera et al, 2010). Desta acção podem resultar perdas de C e N por emissões de dióxido de carbono (CO2), metano (CH4), amoníaco (NH3), óxido nitroso (N2O) e óxido nítrico (NO) e por lixiviação de nitratos (NO3-).
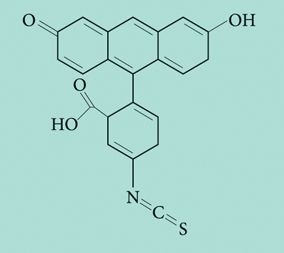
Figura 1. Fórmula química (estrutura molecular) um isotiocianato
A adição de resíduos vegetais compostados ou a sideração de culturas pode ainda ter efeitos positivos sobre as culturas agrícolas e o ambiente devido ao efeito no controlo de pragas e doenças que esses materiais podem apresentar. As plantas produzem uma vasta gama de metabolitos secundários, conhecidos como fitoquímicos, os quais se considera desempenharem um papel importante em mecanismos de defesa contra os herbívoros, micróbios ou de competição com outras plantas (Wink, 1999; Wink 2004).
A função específica de muitos fitoquímicos é ainda incerta, embora um número considerável de estudos tenha mostrado que eles estão envolvidos nas relações entre plantas/pragas/doenças. Podem ainda funcionar como substâncias mensageiras com o objetivo de atração de animais para a polinização ou a dispersão de sementes.
Os fitoquímicos são substâncias de baixo peso molecular e podem ser agrupados em duas classes principais consoante contenham azoto, como fenóis e polifenóis, terpenos e saponinas, ou não contenham azoto, como alcaloides, glucósidos cianogénicos, aminoácidos não-proteicos e glucosinolatos (Wink, 2004; Rosa et al., 2007).
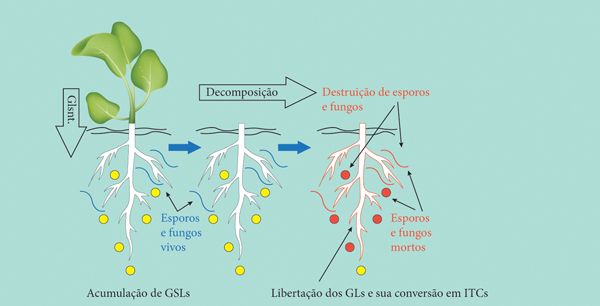
Figura 2. Biofumigação por decomposição de resíduos de brássicas / GLs - Glucosinolatos / ITCs - Isotiocianatos
Existem evidências crescentes de que materiais vegetais contendo glucosinolatos ou ricos em outros fitoquímicos, por exemplo elevadas concentrações de (poli)fenóis, têm a capacidade de actuar como agentes de controlo de numerosas doenças bacterianas e fúngicas, de nemátodos fitoparasitas e na repulsa de insectos e moluscos (Fenwick et al., 1983, Glen et al., 1990; Brown e Morra, 1997; Buskov et al., 2002, Serra et al., 2002; Zasada e Ferris 2004; Lazeri et al. 2004).
No caso da adição de resíduos muito ricos em glucosinolatos, como é o caso das couves (Brassica sp.), o efeito parece estar associado ao catabolismo daqueles compostos através dos seus produtos de hidrólise e especificamente à formação de isotiocianatos (ITC) biologicamente activos (Bones e Rossiter, 1996; Agrawal, 2000; Mithen 2001).
Os ITCs são compostos voláteis de elevada toxicidade cuja acção resulta de reacções irreversíveis com proteínas (Brown e Morra, 1997). Como os isotiocianatos apresentam uma actividade antimicrobiana de largo espectro, a aplicação de resíduos de plantas que produzem estas substâncias activas após hidrolização tem sido designada de “biofumigação” (Angus et al., 1994, Brown e Morra, 1997; Workneh et al., 1993 ). Um outro grupo de compostos secundários que tem assumido uma enorme importância nos últimos anos tem sido o dos fenóis e polifenóis. Estes compostos constituem um grupo quimicamente muito heterogéneo (Harborne, 1999; Podsedek, 2007), o que lhe confere uma grande diversidade de funções entre as quais também a defesa das plantas contra a acção de pragas e ocorrência de doenças (Harborne, 1999).

Campos de colza
A diversidade estrutural dos fenólicos deve-se em grande parte à grande variedade de combinações que acontece na natureza, e com isso tornam-se multifuncionais.
Das diferentes classes de fenólicos presentes nas plantas, pelas suas propriedades antipatogénicas, antimicrobianas e alelopáticas, destacam-se as fitoalexinas, os ácidos fenólicos e os taninos (Afek e Sztejnberg, 1995; Schofield et al., 2001; Ohno, 2001; Qu e Wang, 2008; Vasilakoglou et al., 2011). Estes compostos, quando em elevadas concentrações podem tornar-se tóxicos, actuam como repelentes e servem também como defesa contra o ataque de microrganismos. Esta capacidade poderá constituir uma vantagem aquando da incorporação de adubos verdes de espécies vegetais que tenham uma elevada concentração destes compostos.
Com o controlo de fitopatogéneos por meios químicos, mesmo quando são empregues boas práticas agrícolas, é expectável que persistam resíduos perigosos nos alimentos obtidos e, consequentemente, advenham efeitos negativos na saúde pública e no ambiente.
A utilização de materiais ricos em fitoquímicos bioactivos tem evidenciado progressivamente ser um método alternativo importante e eficaz no controlo de problemas fitopatogénicos economicamente relevantes, permitindo a redução de fertilizantes químicos e pesticidas de síntese e dos problemas a eles associados.
Apesar destes resultados promissores, a aplicação de adubos verdes com o objectivo específico de controlo de pragas e doenças é contudo ainda muito complexa, pois muitas questões estão actualmente por responder.

Como estes compostos são tão reactivos é possível que as doses eficazes no controlo de doenças possam ter efeitos negativos na microfauna e microflora do solo, como por exemplo nas bactérias benéficas e nas micorrizas. Questões como a velocidade de degradação no solo dos glucosinolatos em ITCs, a sensibilidade das culturas a tais aplicações, bem como o cálculo da real quantidade de matéria verde necessária para que estes compostos sejam eficazes nas condições reais de campo, necessitam ainda de ser bem clarificadas. Acresce ainda que devido ao facto dos glucosinolatos não serem biologicamente activos mas sim os seus derivados (ITCs), e porque actualmente se sabe que estes se degradam muito rapidamente no solo, o esclarecimento dos processos de transformação dos glucosinolatos e o controlo dos mecanismos químicos da biofumigação, deverá permitir incrementar a sua eficácia.
Comparativamente, a utilização de resíduos ricos em fenóis e polifenóis pode apresentar vantagens decorrentes da circunstância destes compostos apresentarem maior estabilidade e persistência no solo.
Além das avaliações de “velhos” e “novos” biopesticidas (adubações verdes), é importante ter um conjunto de dados sobre os resultados do efeito da aplicação destas adubações nos microrganismos benéficos do solo, na potencial fitoxicidade e de que forma estas aplicações podem afectar outros processos no solo, como por exemplo a emissão de gases de estufa. ¦
Bibliografia
Afek, U. and Sztejnberg, A. 1995. Scoparone (6,7-dimethoxycoumarin), a citrus phytoalexin involved in resistance to pathogens. In: Daniel, M. L., Purkayastha, Urkayastha, R. P. (Eds.). Handbook of phytoalexin metabolism and action. New York: Marcel Dekker, Inc., p. 263-286.
Agrawal, A. 2000. Benefits and costs of induced plant defenses for Lepidium virginicum (Brassicaceae). Ecology 87: 1804-1813.
Angus, J. F.; Gardner, P. A.; Kirkegaard, J. A. and Desmarchelier, J. M. (1994). Biofumigation: isothiocyanates released from Brassica roots inhibit growth of the take-all fungus. Plant and Soil 162: 107–112.
Bones, A. M. and Rossiter, J. T. 1996.
The myrosinase-glucosinolate system, its organisation and biochemistry. Physiologia Plantarum 97: 194-208.
Brown, P. D. and Morra, M. J. 1997. Control of soil-borne plant pests using glucosinolate-containing plants. Advances Agronomy 61:167–231.
Buskov, S.; Serra, B.; Rosa, E.; Sorensen, H. and Sorensen, J.C. 2002. Effects of intact glucosinolates and products produced from glucosinolates in myrosinase-catalyzed hydrolysis on the potato cyst nematode (Globodera rostochiensis Woll). J. Agric. Food Chem. 50: 690-695.
Cabral, F.; Vasconcelos, E., Goss, M. , & Cordovil, C. 1998 The value, use, and environmental impacts of pulp-mill sludge additions to forest and agric. lands in Europe. Envirl. Ver. 6: 55-64.
Geisselera, D.; Horwath, W. R.; Joergensen, R.G. and Ludwig, B. 2010. Pathways of nitrogen utilization by soil microorganisms – A review. Soil Biol. & Biochem., 42: 2058-2067.
Griffiths, D.W.; Birch, A.N.E. and Hillman, J.R. 1998. Antinutritional coumponds in the Brassicaceae: Analysis, biosynthesis, chemistry and dietary effects – Review article. J. Hort. Sci. Biotech. 73: 1-18.
Harborne J.B., 1999. An overview of antinutritional factors in higher plants. In: Secondary plants products. Antinutritional and beneficial actions in animal feeding. Caygill J.C. and Mueller-Harvey I. (Eds). Nottingham Univ. Press, UK, pp. 7-16.
Hattenschwiler, S.; Tiunov, A.V. and Scheu, S. 2005. Biodiversity and litter decomposition in terrestrial ecosystems. Annual Review of Ecology Evolution and Systematics, 36: 191-218.
Kuai, L.; Doulami, F. and Verstraete, W. 2000 Sludge treatment and reuse as soil conditioner for small rural communities. Bioresourse Tech. 73: 213-219.
Lazzeri, L.; Curto, G.; Leoni, O. and Dallavalle, E. 2004. Effects of glucosinolates and their enzymatic hydrolisis products via myrosinase on the root-knot nematode Meloidogyne incognita (Kofoid et white) Chitw. J. Agric. Food Chem. 52: 6073-6707.
Mithen, R. 2001. Glucosinolates – biochemistry, genetics and biological activity. Plant Growth Regulation 34: 91-103.
Ohno, T. 2001. Oxidation of phenolic acid derivatives by soil and its relevance to allelopathic activity. Journal of Environmental Quality 30: 1631-1635.
Paxton, A. J. D. 2000. Biosynthesis and accumulation of legume phy-toalexins. In: Sharma, R. P.; Salunkhe, D.K. (Ed.). Mycotoxin and phytoalexins. Boca Raton: CRC Press, p. 485-499.
Podsedek, A. 2007. Natural antioxidants and antioxidant capacity of brassica vegetables: A review. LWT: Journal of Food Composition and Analysis 40: 1-11.
Qu, X.H. and Wang, J.G. 2008. Effect of amendments with different phenolic acids on soil microbial biomass, activity, and community diversity. Applied Soil Ecology 39: 172-179.
Rosa, E.A.S.; Bennett, R.N. and Aires, A. 2007. Levels and potential health impacts of nutritionally relevant phytochemicals in organic and conventional food production systems. In: Handbook of Organic Food Safety and Quality, Eds. by Julia Cooper, Urs Niggli and Carlo Leifert, Nafferton Ecological Farming Group. Woodhead Publishing Limited, Cambridge, England, pp. 297-329.
Schofield, O., Mbugua, D.M., Pell, A.N. 2001. Analysis of condensed tannins: a review. Animal Feed Science and Technology 91: 21-40.
Serra, B.; Rosa, E.; Iori, R.; Barillari, J.; Cardoso, A.; Abreu, C. and Rollin, P. 2002. In vitro activity of 2-phenylethyl glucoisnolate, and its hydrolisis derivates on the root-knot nematode Globodera rostochiensis Woll. Sci. Horticulturae 92: 75-81.
Vasilakoglou, I., Dhima, K., Anastassopoulos, E., Lithourgidis, A., Gougoulias, N., Chouliaras, N. 2011. Oregano green manure for weed suppression in sustainable cotton and corn fields. Weed Biology and Management 11: 38-48.
Wink, M. 1999. Introduction: biochemistry, role, and biotechnology of secondary metabolites’, in Michael Wink, Functions of plant secondary metabolites and their explotation in biotechnology. Annual Plant Reviews, Academic Press 3: 1-16.
Wink, M. 2004. Phytochemical diversity of secondary metabolites. Encyclopedia of Plant and Crop Science 915-919.
Workneh, F.; van Bruggen, A.H.C.; Drinkwater, L.E. and Shennan, C. 1993.Variables associated with corky root and Phytophthora root rot of tomatoes in organic and conventional farms. Phytopathol. 83 581–589.
Zasada, I.A. and Ferris, H. 2004. Nematode suppression with brassicaceous amendments: application based upon glucosinolate profiles. Soil Biol. & Biochem. 36: 1017-1024.