Por: Teresa Letra Mateus1,2 e Madalena Vieira-Pinto3
1 Dep. de Medicina Veterinária, Escola Universitária Vasco da Gama, Coimbra.
2 Escola Superior Agrária de Ponte de Lima, Instituto Politécnico de Viana do Castelo.
3 Prof. Inspeção Sanitária. Mestrado Integrado em Medicina Veterinária. CECAV - Univ. de Trás-os-Montes e Alto Douro,
A pathologia dos kistos hydaticos do fígado, não é d'hoje. Já Hippocrates notava que o fígado era susceptível de se encher dum liquido, que se esvasiava, algumas vezes, no peritoneo, produzindo accidentes de tal gravidade que tinham a epiloga-los a morte (Moraes e Costa, 1897).
Equinococose/hidatidose – o que é?
A equinococose/hidatidose é uma zoonose (doença comum ao Homem e aos animais) parasitária causada por Echinococcus spp. um género de parasitas cestodes.
Os termos equinococose e hidatidose são utilizados distintamente para descrever a zoonose nos diferentes hospedeiros. O primeiro termo – Equinococose - refere-se à doença produzida pelo parasita adulto no hospedeiro definitivo (carnívoros domésticos e selvagens). O segundo – Hidatidose - refere-se à infecção provocada pela forma larvar do parasita nos hospedeiros intermediários (ungulados – bovinos, ovinos, caprinos, equinos, suínos, cervídeos, entre outros - domésticos e selvagens, e o Homem), o quisto hidático (Acedo, 1999). De ora avante passaremos a designar a doença apenas pelo nome hidatidose, por ser também nos hospedeiros intermediários que ela assume uma maior importância.
O agente etiológico Echinococcus spp. (Figura 1) é um parasita cestode da família Taeniidae, que vive no intestino delgado de carnívoros domésticos e selvagens e sobrevive no seu interior entre 6-24 meses (Acedo, 1999).

Echinococcus apresenta algumas particularidades que o permite diferenciar do outro género da mesma família, o género Taenia, nomeadamente o facto do parasita adulto ser pequeno, medindo apenas alguns milímetros (2-9 mm) apresentando um estróbilo com poucos segmentos (Eckert et al., 2001; Bowman, 2004). São reconhecidas 6 espécies distintas do género Echinococcus, mas apenas 4 constituirão um problema de saúde pública: E. granulosus, E. multilocularis, E. vogeli e E. oligarthrus (Moro e Schantz, 2009). As duas espécies mais importantes serão E. granulosus e E. multiloculares, a primeira tanto no ciclo doméstico (cão, ruminantes/entre outros) como no selvagem (lobo, cervídeos/entre outros), e a segunda principalmente em animais selvagens (Eckert et al., 2001), contudo vamo-nos debruçar sobre E. granulosus, uma vez que este terá sido identificado em 70% dos casos humanos portugueses (EFSA, 2009), e será a única espécie indígena em Portugal (David de Morais, 1998). Existem diferentes genótipos de E. granulosus, tendo sido, identificados 10 (G1-G10) (Craig et al., 2007), embora a taxonomia de Echinococcus esteja em constante actualização (Tabela 1).
A determinação em cada país dos genótipos aí existentes, reveste-se de grande importância epidemiológica, profilática e clínica, dado que se aceita que existem genótipos que são mais patogénicos para o Homem. A presença do genótipo ovino G1 coincide com a elevada prevalência de hidatidose humana na mesma região e é tido como o mais patogénico para o Homem, sendo que, é também o que possui a mais ampla disseminação mundial (David de Morais, 2011).
Como se transmite?
Cerca de um mês após a infecção, os parasitas adultos presentes no intestino começam a produzir ovos (Figura 2) que são libertados no ambiente com as fezes dos carnívoros (hospedeiros definitivos). O número de parasitas no intestino pode passar os 1000, e cada um pode produzir entre 34-58 ovos diariamente (Acedo, 1999; Eckert et al., 2001).
É desta forma que ocorre a contaminação ambiental, o que inclui a contaminação dos pastos, águas e alimentos. Quando eliminados pelas fezes, os ovos são infectantes para os hospedeiros intermediários nos quais se inclui o Homem (Acedo, 1999; Eckert et al., 2001). No que diz respeito aos humanos, estes também podem ser infectados através do contacto próximo com o cão, uma vez que os ovos se podem espalhar por todo o pêlo do animal. Um simples gesto de passar a mão pelo pêlo do cão (ou ser lambido por este) leva a que os ovos adiram às mãos. Se estas não forem lavadas, ao serem conduzidas à boca, podem ingerir-se os ovos (Acedo, 1999; Eckert et al., 2001).
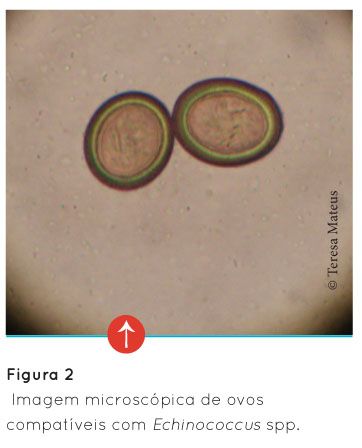
Os ovos de Echinococcus granulosus eliminados nas fezes dos carnívoros podem permanecer viáveis no ambiente durante mais de um ano, podendo inclusivamente resistir a temperaturas inferiores a 0 ºC durante 4 meses (Gracey et al.,1999; Bowman, 2004). Depois de um hospedeiro intermediário ingerir os ovos viáveis, a camada de queratina protectora do ovo é destruída pelas enzimas proteolíticas dos sucos gástricos libertando a oncosfera, que penetra através do duodeno e do íleo, até alcançar um vaso sanguíneo ou linfático para chegar passivamente a diversos órgãos (fígado, pulmão, rins, baço, cérebro, músculos, osso, entre outros) (Acedo, 1999; Eckert et al., 2001). Nos órgãos infectados vão-se desenvolver quistos hidáticos (Figura 3), originando a hidatidose.
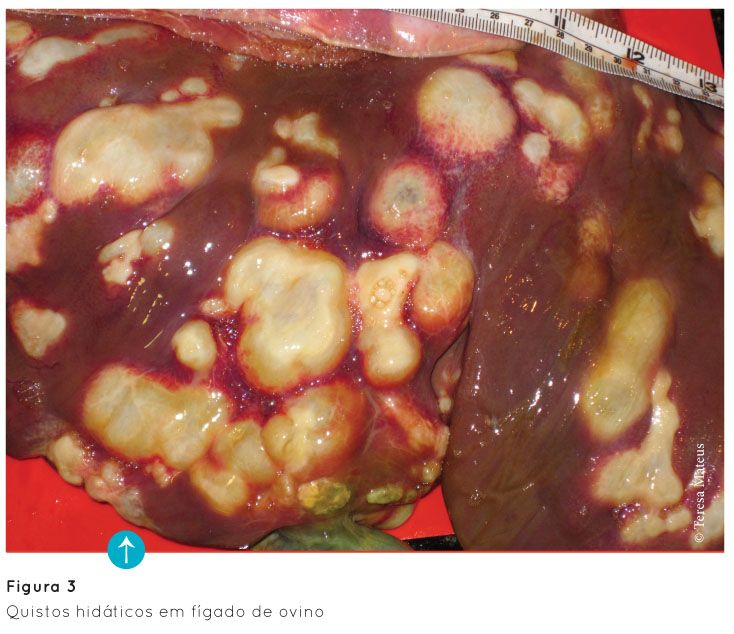
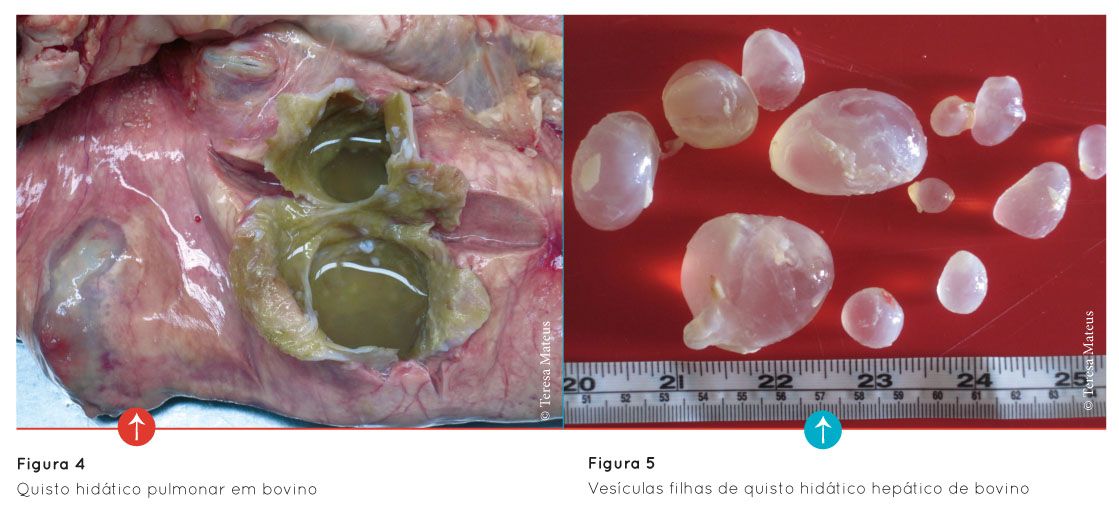
O quisto hidático é uma vesicula arredondada que contém um líquido claro (líquido hidático – Figura 4). A sua parede é constituída por uma membrana branca acinzentada e opaca. Dentro do quisto podemos encontrar além do líquido hidático vesículas filhas (Figura 5).
Os hospedeiros definitivos infectam-se ao ingerir quistos hidáticos presentes nas vísceras de ungulados infectados, levando ao desenvolvimento de parasitas adultos no intestino (Figura 6). Por cada quisto hidático ingerido pelo hospedeiro definitivo, muitos parasitas adultos podem desenvolver-se, dependendo do número de vesículas filhas férteis desse quisto (cada uma dará origem a um novo parasita adulto) (Ballweber, 2001).
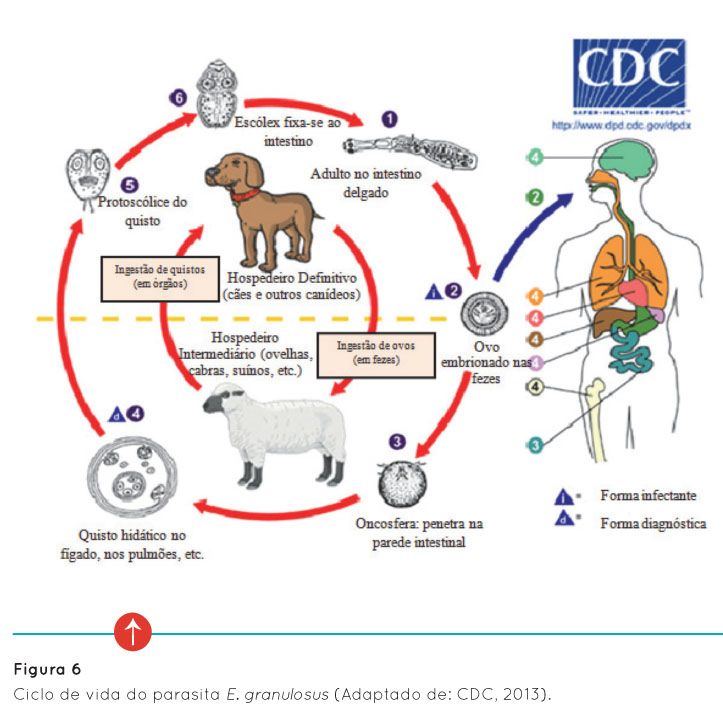 A hidatidose no mundo, na Europa e em Portugal
A hidatidose no mundo, na Europa e em Portugal
Vários estudos indicam que a hidatidose é uma doença de interesse crescente na saúde pública, sendo vista como uma doença emergente ou reemergente (Jenkins et al., 2005).
Trata-se duma doença que causa grande morbilidade e mortalidade no Homem (Budke et al., 2006) e significativas perdas económicas na produção animal (Benner et al., 2010). Esta zoonose tem uma distribuição mundial, estando presente em todos os continentes (Eckert et al., 2000). Na Europa, Moro e Schantz (2009) afirmam que a infecção por Echinococcus granulosus reemergiu em zonas onde se julgava controlada – como na Bulgária e no país de Gales. Neste continente a região mais afectada é a do Mediterrâneo (Jenkins et al., 2005), onde será a zoonose parasitária mais importante da região (Seimenis, 2003). Pardo et al. (2005) concluem no seu estudo realizado na província de Salamanca, que a hidatidose é uma doença reemergente, com uma incidência real em humanos superior ao previamente estimada. Em algumas regiões de Espanha, as taxas de incidência de hidatidose humana são de 1,1 a 3,4 casos por 105 habitantes, e coexistem com prevalências de hidatidose ovina e bovina de 23% (Carmena et al., 2008). Em Portugal, David de Morais (2007) mostrou no seu estudo que o distrito de Évora era hiperendémico. A classificação de zona hiperendémica é atribuída quando se verifica uma incidência de pelo menos 10 casos/100000 habitantes por ano. Contudo, o mesmo autor defende que em virtude da extinção da transumância, de notórias mudanças socioeconómicas ocorridas no meio rural e da "modernização" do maneio do gado, a parasitose terá entrado em declínio (David de Morais, 2007, 2009).
Em Portugal, a incidência da hidatidose humana aumenta de norte para sul, com o Alentejo a deter os mais importantes valores, mas a hidatidose animal segue no sentido inverso, aumentando de sul para norte (David de Morais, 2011), o que pode ser explicado pelos diferentes genótipos e grau de patogenicidade de Echinococcus. No concelho de Cantanhede foi iniciado um estudo de caso em 2004, para o qual se fez um levantamento da existência de quisto hidático em suínos, justificado pela existência de casos notificados em humanos e pela tradição e valor económico que representa o porco na Bairrada através do consumo do leitão. Acompanharam-se 66 abates em contexto familiar, para autoconsumo, tendo 10,6% dos suínos apresentado quisto hidático macroscópico, principalmente no fígado (Conceição et al., 2005).
No Norte, o distrito de Vila Real tem sido aquele onde se têm registado mais casos humanos, seguido do distrito de Bragança. No concelho de Vinhais, pertencente ao distrito de Bragança, numa avaliação epidemiológica levada a cabo em 2006 foi feito um estudo exaustivo da doença, quer em humanos, quer em animais. No levantamento efectuado em suínos detectou-se a presença de quistos hidáticos em 8,1% dos animais, e em pequenos ruminantes, uma prevalência média de 30%. No mesmo estudo, a pesquisa de ovos em amostras fecais de cães recolhidas nas ruas e praças teve um resultado de 7% positivas para o parasita Echinococcus granulosus. Foram ainda feitas recolhas de sangue a pastores de ovinos e a criadores de suínos e em 12,6% das amostras houve reconhecimento de antigénios específicos de Echinococcus granulosus (Castro et al., 2006).
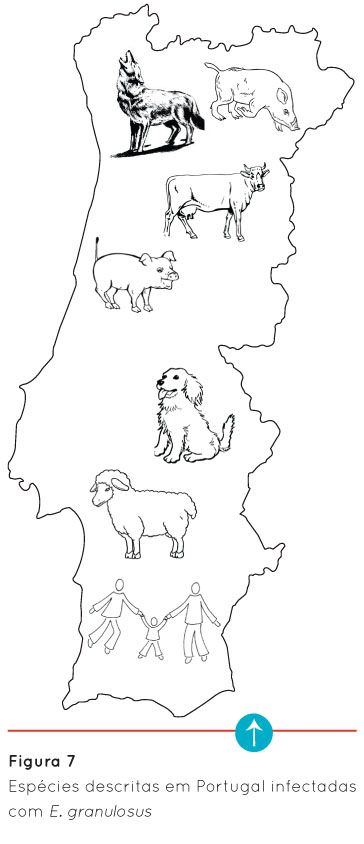
No que diz respeito a animais selvagens, Vieira-Pinto et al. (2011) identificaram quistos hidáticos em javalis e Guerra et al. (2013) Echinococcus granulosus em lobos ibéricos, ambos no Norte. Na Figura 7 estão representadas as espécies onde já foram descritas infecções com Echinococcus granulosus em Portugal.
A hidatidose, é considerada uma doença de declaração obrigatória (DDO) para a Organização Mundial da Saúde Animal (OIE), e para a Direcção Geral de Saúde (DGS) em Portugal. Segundo o mais recente relatório da Autoridade Europeia para a Segurança Alimentar (EFSA, 2013) em 2011 terão sido notificados 781 casos humanos de hidatidose na União Europeia. Destes, 1 terá sido em Portugal. Num relatório semelhante mas das DDO da DGS (DGS, 2008), em Portugal foram notificados 53 casos humanos no quinquénio de 2002-2006. Contudo, David de Morais (2007) refere no seu estudo, que foram diagnosticados uma média de 122 casos humanos por quinquénio, apenas no distrito de Évora, os que nos leva a considerar a possibilidade de haver uma subnotificação dos casos confirmados. Só no Instituto Nacional de Saúde Dr. Ricardo Jorge, Delegação do Porto, são confirmados anualmente entre 30 a 40 novos casos, pelo que existe uma evidente falta de notificação dos casos identificados, tal como sugerido por Seimenis (2003).
Que sintomas e consequências nos animais e no Homem?
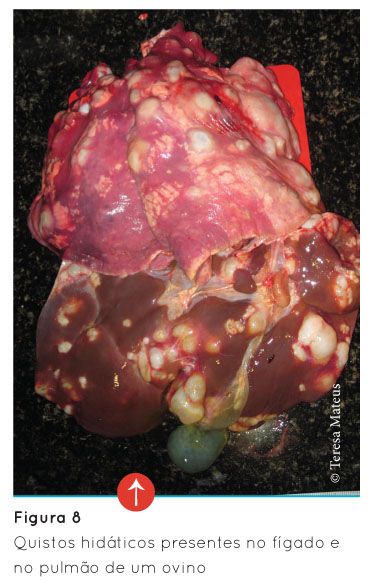
A hidatidose é uma patologia de desenvolvimento crónico, uma vez que os quistos podem levar meses a anos para se desenvolverem (Acedo, 1999). Os quistos variam de tamanho (podem atingir 20 cm de diâmetro), forma, e podem até estar presentes em grande número em um único órgão (Eckert e Deplazes, 2004). No Homem e restantes hospedeiros intermediários, o desenvolvimento dos quistos hidáticos acontece sobretudo no fígado e nos pulmões (Figura 8), podendo ser assintomático durante anos, surgindo os sinais clínicos tardiamente como resultado da disfunção dos órgãos afectados, ou mesmo nunca surgindo (McManus et al., 2003).
A hidatidose nos animais repercute-se em perdas, por reprovação de órgãos em matadouro e de produtividade, nomeadamente quebras na produção de carne e de leite (Eckert et al., 2001).
Nos humanos, dependendo dos órgãos afectados, a sintomatologia pode ser muito variável (McManus et al., 2003). Os quistos de localização pulmonar podem produzir quadros alérgicos e tosse com eliminação de expectoração sanguinolenta. Muitas vezes infecções secundárias levam à formação de um abcesso pulmonar crónico (Acedo, 1999). Quando a localização do quisto é hepática, os sinais clínicos que frequentemente se apresentam são dor abdominal, febre, náuseas, ascite, vómitos e diarreia. Apesar de serem mais frequentes nos pulmões e fígado, os quistos podem surgir no coração, rim, baço, tiróide, cérebro e tecido ósseo. A hidatidose óssea produz dor focal (dor nas costas, dor ciática, fracturas, paresias ou paraplegias) e normalmente, de mau prognóstico (Eckert e Deplazes, 2004). Se os quistos rupturam a libertação súbita do seu conteúdo precipita uma reacção alérgica anafiláctica que pode ser fatal (Moro e Schantz, 2009). A rutura de um quisto, não sendo fatal, dispersa fragmentos por toda a cavidade pleural ou peritoneal, provocando assim hidatidose múltipla (Ballweber, 2001). No Homem, a hidatidose é difícil de tratar (Budke et al., 2005) e aquando do tratamento (que é quase sempre cirúrgico), não raras vezes ocorrem complicações graves (Ouerghi et al., 2010).
Como podemos prevenir a hidatidose?
São tantas as difficuldades na diagnose dos kistos hydaticos, e o medico vê-se tão seriamente embaraçado, que, se quizer ter a presumpção de a determinar com segurança, erra o mais das vezes. (Moraes e Costa, 1897)
De facto, passados que estão mais de 100 anos sobre esta citação, continua a ser difícil diagnosticar a hidatidose no Homem, pelo que será sempre melhor preveni-la!
Educar para Saúde
Seimenis (2003), um perito da Organização das Nações Unidas para a Agricultura e a Alimentação, nomeia algumas causas para a falha na prevenção: a escassez de dados sobre a prevalência desta doença quer em animais, quer em humanos; a não existência de trabalho e comunicação inter-sectorial entre os técnicos de saúde pública humana e animal; a falta de conhecimento da população e até dos grupos de risco, pelo não investimento em planos de educação para a saúde na prevenção das zoonoses. O envelhecimento da população e o aumento dos indivíduos imunodeprimidos (com doenças crónicas: oncológicas, cardiovasculares, alergénicas, diabéticas, entre outras) enfatizam a necessidade de maior reconhecimento das doenças zoonóticas (Wiedmann, 2003).
Apesar da hidatidose humana ser uma infecção severa e frequentemente fatal, a sua importância não é reconhecida pelas autoridades de saúde de muitos países (Eckert e Deplazes, 1999). A educação para a saúde é uma ferramenta básica na saúde pública, nomeadamente na prevenção e controlo de zoonoses como a hidatidose, e os profissionais de saúde são o elemento chave (Eckert et al., 2001). Vários estudos demonstram que a comunidade médica “delega” nos médicos veterinários a função de educação para a saúde relativamente à zoonoses (Chomel, 2008), pelo que é necessário sensibiliza-los para esta função. O desenvolvimento de estratégias para informar a comunidade do risco e da prevenção das zoonoses deve ser baseado não só nos resultados da investigação científica dos factores de risco, mas também na análise da percepção do problema pela comunidade (Slovic et al., 2005). Esta pode diferir de região para região, pelo que a comunicação sobre as medidas de prevenção a serem adoptadas deverão ser adaptadas às situações regionais específicas (Hegglin et al., 2008). Esta questão é referida por Seimenis (2003), concretamente para o controlo da hidatidose na região do Mediterrâneo recordando as festividades locais e religiosas que acontecem associadas a abates tradicionais de animais, e que constituem ocasiões ideais para a propagação da infecção para carnívoros e para o Homem. O mesmo em relação aos proprietários de carnívoros, o controlo da hidatidose será muito pouco eficaz sem a sua colaboração, que só será conseguida se tiverem entendido claramente o ciclo de vida deste parasita e os factores de risco para a infecção humana.
A educação para a Saúde na prevenção da hidatidose poderia começar por referir cuidados gerais como a lavagem e desinfecção de vegetais e frutas a consumir cruas, o não consumo de água não tratada, e a frequente lavagem das mãos, sobretudo depois de realizar trabalhos agrícolas, pecuários ou de jardinagem (Pasquali, 2004).
Sabe bem partilhar, mas parasitas nem pensar! – cuidados com os carnívoros
As péssimas condições hygienicas em que vive o povo portuguez, tanto das aldeias como das cidades, a alimentação descuidada, exigua e muitas vezes imprópria, são a concorrente mais poderosa para que o hydatidismo, seja frequente entre nós…(…)não ha povoação onde se não encontre, em promiscuidade o homem e os animaes domésticos, e muito principalmente o cão. Ás vezes o prato e a tigela são communs. Onde come o dono, come o cão. (Moraes e Costa, 1897)
À medida que as comunidades se tornam mais urbanas, a presença dentro das habitações de animais de companhia, alguns dos quais exóticos até, tem aumentado de popularidade. Os animais de companhia tornaram-se uma extensão da própria família. Estes amigos trazem imensos benefícios nomeadamente suporte psicológico, amizade e até práticas saudáveis, por exemplo de exercício físico (Overgaauw et al., 2009). Contudo, eles não só estão na nossa vida e ambiente diário, como conquistaram mesmo o nosso quarto, partilhando as nossas horas de descanso, mas também, um risco – o de transmissão de zoonoses (Chomel e Ben, 2011).
O controlo de cães vagueantes – com ou sem proprietário – que podem encontrar vísceras ou cadáveres contaminados no ambiente, assim como contaminar os cursos de água, pastagens ou hortas, deve ser eficiente. Os cães devem ser desparasitados, e as suas fezes durante pelo menos 3 dias após a desparasitação, convenientemente eliminadas (misturadas com lixívia, cal viva ou enterradas). Deve ser evitado o contacto directo com fezes de cão, ou com materiais/equipamentos que possam por elas estar contaminados, caso aconteça, devem ser lavadas as mãos de seguida (Pasquali, 2004). Deve ainda ser proibida a alimentação de cães com vísceras cruas. A cozedura durante 40 minutos ou a congelação a -18ºC, durante um mínimo de 48h, é recomendada (Acedo, 1999; Bowman, 2004).
Em Portugal, a produção pecuária extensiva tradicional, em especial de ovinos, com pastores apoiados por cães de gado (Figura 9), associada à falta de educação sanitária das populações e aos abates clandestinos de ovinos, constituem uma fonte de re-infecção dos cães, e estes, quer conspurcando o meio, quer por contacto directo, infectam o Homem com ovos de E. granulosus (David de Morais, 2010).

Não se julgue contudo, que se trata duma zoonose rural, já que a sua ocorrência em áreas urbanas tem tido um aumento significativo devido à migração de cães infectados por E. granulosus (Hoffman et al., 2001). Na maior parte dos casos a infeção dos humanos ocorre através do cão doméstico e a primeira linha de defesa é uma higiene escrupulosa.
Os ovos, assim dispostos, podem com facilidade communicar-se ao homem, já pelas caricias que o dono faz a estes animaes, já porque muitas pessoas ha que se deixam lamber pelos cães e muitas vezes na face. (Moraes e Costa, 1897)

Muito facilmente, um animal ao lamber-se pode passar ovos presentes no ânus para a boca e posteriormente para as pessoas. Assim, devemos naturalmente evitar situações como a da Figura 10.
A contaminação do pêlo dos cães com ovos de origem fecal, é considerada a forma mais comum do Homem se infetar (Bowman, 2004).
Evitar os “abates caseiros” e promover a inspecção sanitária
Porém, o principal meio de transmissão, são os alimentos de que já falíamos. (Moraes e Costa, 1897)
A inspeção sistemática de todos os animais abatidos e a posterior destruição dos órgãos afetados é a forma mais eficaz de interromper o ciclo biológico do parasita e diminuir a incidência da parasitose tanto nos animais como no Homem (Gracey et al., 1999). Assim, cenários como os da Figura 11, são altamente desaconselhados.

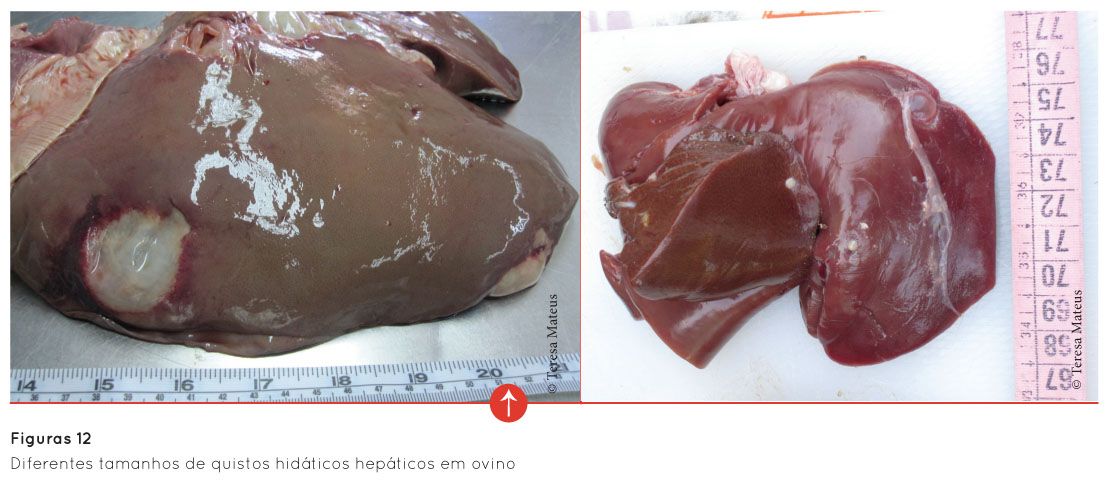
Como já foi referido anteriormente, o tamanho dos quistos pode ser muito variável, sendo quase imperceptíveis (<1 cm) até vários centímetros de diâmetro (Figura 12), escapando mesmo a um olhar mais atento. Daí a importância de a inspecção sanitária ser feita por médicos veterinários habilitados para o efeito.
Se é caçador, tome nota…
Frequentemente, os caçadores executam uma má prática que é oferecer as vísceras cruas à sua matilha, estando desta forma a perpetuar ciclos biológicos de parasitoses e infectando deliberadamente os seus cães com possíveis microrganismos patogénicos. Outras vezes, quando se apercebem que os ungulados selvagens estão doentes ou não aptos para consumo próprio estes são abandonados na floresta e depois consumidos quer por carnívoros selvagens, quer por carnívoros errantes, ou até mesmo domésticos. Gortázar et al. (2007) defendem então a necessidade de implementar medidas de higiene no sector da caça, relativamente à inspecção das carcaças e destruição dos despojos.
A interface animais de produção pecuária/animais selvagens é cada vez mais próxima. A título de exemplo podemos referir o facto de estar a ser privilegiada a produção extensiva de animais, e ao mesmo tempo, devido a limitações várias no habitat selvagem, os animais selvagens procuram alimento mais próximo das comunidades, promovendo assim uma maior interacção não só com os animais domésticos, mas com o próprio Homem. É bem conhecido o fenómeno da quase domesticação de raposas em algumas cidades europeias (Gortázar et al., 2007), e em Portugal, Pinto et al. (2011) relatam o mesmo fenómeno na região do Grande Porto, em Vila Nova de Gaia.
A proximidade dos animais selvagens do Homem podem fazer reemergir doenças, nomeadamente a hidatidose, afinal uma velha doença num tempo novo, que esperamos tenham entendido respeitar!
Bibliografia
-
- Acedo, C. S. 1999. Parasitosis sistémicas. In Parasitología Veterinaria, Eds. Campillo, C. M. e Vázquez, F. A. R., McGraw-Hill interamericana, 319-362.
- Ballweber, L. R. 2001. Parasites of the Gastrointestinal Tract II – Acanthocephalans, Cestodes, and Trematodes. In Veterinary Parasitology, Butterworth-Heinemann, 165-189.
- Benner, C., Carabin, H., Sanchez-Serrano, L. P., Budke, C. M., Carmena, D. 2010. Analysis of the economic impact of cystic echinococcosis in Spain. Bulletin of the World Health Organization, 88(1), 49-57.
- Bowman, D. D. 2004. Helmintos. In Georgis Parasitología para Veterinários. Elsevier, 8.ª edición, 121-254.
- Budke, C. M., Deplazes, P., Torgerson, P. R. 2006. Global socioeconomic impact of cystic echinococcosis. Emerging Infectious Diseases, 12(2), 296-303.
- Carmena, D., Sanchez-Serrano, L. P., Barbero-Martinez, I. 2008. Ecinococcus granulosus infection in Spain. Zoonoses and Public Health. 55(3): 156-165.
- Castro, A., Silva, E., Freire, L., Conceição, A., Costa, J. M. 2006. Relatório do Centro Regional de Saúde Pública do Norte, Porto. Instituto Nacional de Saúde Dr. Ricardo Jorge: Instituto Nacional de Saúde Dr. Ricardo Jorge. Porto. Portugal.
- CDC. 2013. Echinococcus granulosus life cycle. Available at: http://www.dpd.cdc.gov/dpdx/HTML/Echinococcosis.htm. Consultado em 23-04-2013.
- Chomel, B. B. 2008. Control and prevention of emerging parasitic zoonoses. International Journal for Parasitology, 38(11), 1211-1217.
- Chomel, B. B., Ben, S. 2011. Zoonoses in the bedroom. Emerging Infectious Diseases, 17(2), 6.
- Conceição, M. A. P., Silva, M., Veloso, G., Castro, A., Silva, E., Cravo, I. 2005. Hidatidose Suína – estudo de caso no concelho de Cantanhede. Paper presented at the III Congresso Ibérico de Hidatidologia, Elvas.
- Craig, P. S., McManus, D. P., Lightowlers, M. W., Chabalgoity, J. A., Garcia, H. H., Gavidia, C. M. 2007. Prevention and control of cystic echinococcosis. Lancet Infect Dis, 7(6), 385-394.
- David de Morais, J.A. 1998. A Hidatidologia em Portugal (série ?Manuais Universitários?). Lisboa: Fundação Calouste Gulbenkian.
- David de Morais, J.A. 2007. Hidatidose humana. Estudo clínico-epidemiológico no distrito de Évora durante um quarto de século. Acta Med Portuguesa 2007; 20: 1-10.
- David de Morais, J.A. 2009. Ascensão e declínio da hidatidose humana em Portugal. Acta Parasitológica Portuguesa 2009; 16(1/2): 144-5.
- David de Morais, J.A. 2010. Progressão e declínio da hidatidose humana em Portugal: analise histórico-epidemiológica. Medicina Interna, 4 (17), 274-285.
- David de Morais, J.A. 2011. A subespeciação do Echinococcus granulosus em Portugal. Revista Portuguesa de Doenças Infecciosas, 3 (7), 98-143.
- DGS. 2008. Doenças de Declaração Obrigatória 2003-2007. 1-49. Site disponível: Direcção Geral de Saúde (última actualização: s/d), URL: http://www.dgs.pt/. Consultado em 23-04-2013.
- Eckert, J., Conraths, F. J., Tackmann, K. 2000. Echinococcosis: an emerging or re-emerging zoonosis?. International Journal for Parasitology, 30, 1283-1294.
- Eckert, J., Gemmel, M. A., Meslin, F.-X., Pawlowski, Z. S. 2001. WHO/OIE Manual on Echinococcus in Humans and Animals: a Public Health Problem of Global Concern. World Organisation For Animal Health. 286.
- Eckert, J., Deplazes, P. 2004. Biological, Epidemiological, and Clinical Aspects of Echinococcosis, a Zoonosis of Increasing Concern. Clinical Microbiology Reviews, 17 (1), 107-135.
- Eckert, J., Deplazes, P. 1999. Alveolar echinococcosis in humans: The current situation in Central Europe and the need for countermeasures. Parasitology Today, 15(8), 315-319.
- EFSA. 2009. Development of harmonised schemes for the monitoring and reporting of Echinococcus in animals and foodstuffs in the European Union. Available at: http://www.efsa.europa.eu/en/scdocs/doc/36e.pdf. Consultado em 23-04-2013.
- EFSA. 2013. Scientific Report of EFSA and ECDC. The European Union Summary Report on Trends and Sources of Zoonoses, Zoonotic Agents and Food-borne Outbreaks in 2011. Available at: http://www.efsa.europa.eu/en/efsajournal/doc/3129.pdf. Consultado em 23-04-2013.
- Gortázar, C., Ferroglio, E., Höfle, U., Frölich, K., Vicente, J. 2007. Diseases shared between wildlife and livestock: a European perspective. Eur. J. Wildlife Res. 53:241-256.
- Gracey J., Collins D.S., Huey R. 1999. Diseases caused by helminth and arthropod parasites. In: Meat hygiene, 10th Ed. WB Saunders, UK, pp 635–699.
- Guerra, D., Arnua-Fernandez, M. T., Silva, M., Bravo. I., Santos, N., Deplazes, P., Madeira de Carvalho, L.M. 2013. Taeniid species of the Iberian wolf (Canis lupus signatus) in Portugal with special focus on Echinococcus spp. International Journal for Parasitology. 2: 50–53.
- Hegglin, D., Bontadina, F., Gloor, S., Romig, T., Deplazes, P., Kern, P. 2008. Survey of public knowledge about Echinococcus multilocularis in four European countries: Need for proactive information. Bmc Public Health, 8.
- Hoffman, A. N., Malgor, R., Rue, M. L. 2001. Prevalência de Echinococcus granulosus (Batsch, 1786) em cães urbanos errantes no município de Dom Pedrito (RS), Brasil. Ciência Rural, Santa Maria, 5 (31), 843-847.
- Jenkins, D. J., Romig, T., Thompson, R. C. A. 2005. Emergence/re-emergence of Echinococcus spp.- a global update. International Journal for Parasitology, 35(11-12), 1205-1219.
- McManus, D. P., Zhang, W., Li, J., Bartley, P. B. 2003. Echinococcosis. The Lancet, 362(9392), 1295-1304.
- Manterola, C., Melo, A., Vial, M., Roa, J. C., Mora, J., 2006. Descripción de genótipos de Echinococcus granulosus obtenidos de espécimenes de hidatidose humana. Revista Chilena de Cirurgía, 6 (58), 441-446.
- Moraes e Costa, M. (1897). Duas palavras sobre kistos hydaticos do fígado e o seu tratamento. Dissertação apresentada à Escola Médico-Cirúrgica do Porto.
- Moro, P., Schantz, P. M. 2009. Echinococcosis: a review. Int J Infect Dis, 13(2), 125-133.
- Ouerghi, S., Abdelhafidh, K., Merghli, A., Smati, B., Boudaya, M. S., Lamine, K. 2010. Iatrogenic gas embolism after use of hydrogen peroxide in the treatment of lung hydatid cyst: a report of 2 cases. Tunis Med, 88(11), 851-854.
- Overgaauw, P. A. M., van Zutphen, L., Hoek, D., Yaya, F. O., Roelfsema, J., Pinelli, E. 2009. Zoonotic parasites in fecal samples and fur from dogs and cats in The Netherlands. Veterinary Parasitology, 163(1-2), 115-122.
- Pardo, J., Muro, A., Galindo, I., Cordero, M., Carpio, A., Siles-Lucas, M., 2005. Hidatidosis en la provincia de Salamanca: debemos bajar la guardia?. Enferm. Infecc. Microbiol., 23 (5), 266-269.
- Pasquali, P. 2004. HIV Infections and Zoonoses. FAO Animal Production and Health. 163. Rome. 31 pp.
- Pinto, V., Soeiro, V., Oliveira, H., Valente, A. 2011. Foxes a tour doorstep. Urban foxes in Vila Nova de Gaia. 4th meeting of young researchers at UP. Book of abstracts: 376.
- Seimenis, A. 2003. Overview of the epidemiological situation on echinococcosis in the Mediterranean region. Acta Tropica, 85, 191-195.
- Slovic, P., Peters, E., Finucane, M. L., MacGregor, D. G. 2005. Affect, risk, and decision making. Health Psychology, 24(4), S35-S40.
- Vieira-Pinto, M.M., Mateus, T., Gargaté, M.J., Vilares, A., Ferreira, I., Coelho, C., Rodrigues, M. 2011. First identification of Echinococcus ortleppi in free living wild boar (Sus scrofa) from Portugal. VI International Symposium on Wild Fauna. Edinburgh. UK.
- Wiedmann, M. 2003. ADSA foundation scholar award - An integrated science-based approach to dairy food safety: Listeria monocytogenes as a model system. Journal of Dairy Science, 86(6), 1865-1875.